Actualités
Actualités 

L’année 2019 qui s’est terminée avait été proposée par l’Assemblée générale des Nations Unies et approuvée par la conférence générale de l’UNESCO : « Année internationale du Tableau périodique des éléments », le Tableau périodique étant l’outil qui permet aux scientifiques du monde entier de prédire et d’expliquer les propriétés de la matière visible sur terre et dans tout l’univers.
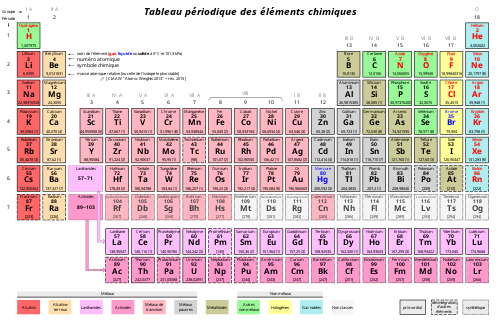
L’histoire moderne de la connaissance des éléments chimiques et de leur classement selon leurs propriétés dans un tableau périodique a commencé voici 250 ans avec Lavoisier et ses contemporains du siècle des lumière qui voulaient « éclairer » le monde par la raison et la science. L’étude se poursuit encore en ce début de XXIème siècle, notamment par la compréhension de l’origine des noyaux atomiques et la synthèse de noyaux lourds et instable, la dernière grande étape de cette « saga ». La longue histoire du tableau périodique peut se classer en deux grandes parties : celle des chimistes qui rangent les éléments en fonction de leur masse atomique croissante et de leurs ressemblance chimique, parcours qui marque un succès en 1869 avec la classification proposée par Mendeleïev et voit son plein accomplissement après la découverte des gaz inertes à la fin du XIXème siècle. La seconde étape, qui chevauche la première sur une ou deux décades, débute sérieusement au début du XXème siècle avec la découverte de la structure de l’atome : électron, protons… et l’apparition de la physique quantique, elle conduit à une classification basée sur le numéro atomique c’est-à-dire sur le nombre de protons.
Antoine Lavoisier (1743-1794) avait hérité d’une charge de fermier général, il était donc collecteur d’impôt, par ailleurs, il était en charge pour le gouvernement, des poudres et salpêtres ; avec son épouse et collaboratrice, Anne-Marie Pierrette, il avait construit un laboratoire dans les combles de leur logement de fonction. Lavoisier disposait des meilleures balances de son époque, lui permettant de mesurer fidèlement les entrants et sortants solides, liquides ou gazeux de toute réaction chimique. Bien qu’il ne semble pas avoir prononcé cette phrase, toute son œuvre pourrait se résumer par l’expression : « en chimie, rien ne se perd, rien ne se crée, tout se transforme ». Il a démontré le non-fondé de la théorie du phlogistique. A partir de ses travaux, les chimistes mesurèrent les proportions qui rentraient en réaction et comparèrent les éléments qu’ils connaissaient en fonction de leur masse atomique. Rapidement, on a compris que le plus léger de tous les éléments connus était l’hydrogène, sa masse fut prise égale à un gramme, par définition. John Dalton (1766-1840) proposa aussi dès 1808 sa théorie atomique qui mis plus d’un siècle avant d’être admise définitivement. Pendant tout ce temps, Volta inventa la pile électrique, on découvrit l’électrolyse, on isola grâce à celle-ci de nouveaux éléments. En 1808, Humphry Davy révéla des propriétés communes à la triade d’éléments : Calcium, strontium, baryum puis quelques années plus tard, à une autre, lithium, sodium et potassium ; en 1850, une vingtaine de triades étaient identifiées. Pendant presque un siècle les « proportionistes », ceux qui défendaient le fait que les éléments se combinent simplement selon des proportions bien définies et les atomistes, ceux qui, comme John Dalton, justifient ces proportions par l’existence des atomes qui se lient selon des règles particulières, s’affrontèrent. Ce ne fut qu’au congrès de Karlsruhe (1860), considéré comme le premier congrès international scientifique, que les deux points de vue apparurent identiques au plus jeunes. A ce congrès, on reconnut que les gaz hydrogène, oxygène, azote, fluore, chlore, iode se présentaient sous une forme diatomique, on admit aussi l’existence des valences. Jean-Baptiste Dumas ajouta un quatrième élément à certaines triades qui devinrent des tétrades, telles celles du fluor, chlore, brome et iode ou magnésium, calcium, strontium et baryum. Fort de ces nouvelles contestations, Dmitri Mendeleïev recalcula ou remesura les masses atomiques d’un grand nombre d’éléments et après un effort intense qui dura presque une décennie il proposa une classification périodique de la soixantaine d’éléments connus à l’époque. Des manques apparaissaient dans ce tableau, Mendeleïev en prédit les masses atomiques et les propriétés. Ces manques furent comblés par la découverte du gallium, du germanium et du scandium quelques années plus tard, ce qui fit la renommée de ce chimiste. En 1869, les gaz rares n’étaient pas connus, on ne savait donc pas où interrompre une ligne ; dans le tableau de Mendeleïev, les alcalins suivent les halogènes. Ce n’est qu’à la découverte de ces éléments inertes, au tout début du XXème siècle, par William Ramsay, que le tableau périodique des chimistes prit la forme que l’on lui connait aujourd’hui.
A partir de la découverte de l’électron par J.J. Thomson au tournant des XIXème et XXème, il a fallu moins d’un demi-siècle aux physiciens pour justifier par la mécanique quantique les acquis expérimentaux des chimistes. E. Rutherford montre en 1911 que les charges positives qui rassemblent la masse d’un atome occupent un très petit volume : l’atome est constitué en apparence de « vide ». A partir de ces observations, Bohr élabore un modèle planétaire de l’atome, mais il ne doit autoriser que certains niveaux d’énergie pour rendre compte des raies d’absorption de l’hydrogène. H. Moseley montre avant le conflit 1914-1918, où il trouvera la mort, que la fréquence des rayons X émis par une cible métallique est proportionnelle au carré de son nombre de protons, il met ainsi en évidence le numéro atomique. Malgè de rapides succès avec l’atome d’hydrogène, le modèle Bohr conduit à une impasse, et c’est après la découverte de la dualité onde-électron par L. de Broglie que E. Schrödinger propose sa célèbre équation dans laquelle la fonction d’onde est telle que le carré de son module représente la probabilité de rencontrer un électron dans le volume considéré. La résolution de cette équation nécessite l’introduction de quatre nombres dits nombres quantiques : n (nombre quantique principal, entier positif non nul) ; l (nombre quantique secondaire, entier positif ou nul pouvant prendre toutes les valeurs jusqu’à n-1) ; m (nombre quantique magnétique, négatif, nul ou positif pouvant prendre toutes les valeurs de -m à +m) et s (nombre quantique de spin, +½ ou – ½). La nouvelle physique, appelée, « physique quantique » montre par ailleurs que la couche extérieure d’un atome ne peut dépasser huit électrons et qu’après remplissage complet, cette couche contient 2 n2 électrons. Le remplissage complet se fait par retour en arrière d’une unité du nombre n pour chacune des séries des métaux de transition et de deux unités pour les séries des lanthanides (terres rares) et les actinides.
Ainsi, à la fin des années quarante du siècle dernier, le tableau périodique des éléments avait la configuration que l’on lui connait maintenant : les propriétés des éléments trouvaient leur justification par leurs structures électroniques qui, elles-mêmes, ne dépendent que de leur numéro atomique. C’est ce travail considérable, sur plus de deux siècles - dans lequel des milliers de femmes et d’hommes du monde entier ont apporté leur contribution par la découverte de nouveaux éléments, la découverte de nouvelles propriétés des éléments connus, l’élaboration d’hypothèses, la formulation d’interprétations, de synthèses… - qui a fait de ce tableau, un chef d’œuvre, symbole de ce que l’Humanité peut accomplir de mieux quand elle œuvre collectivement à la recherche de la Vérité scientifique.
Jean-Pascal DUCHEMIN
Ingénieur et Docteur d'Etat
IESF-IdF



















 Accès au répertoire IESF
Accès au répertoire IESF